Como nomear compostos químicos
Autor:
Laura McKinney
Data De Criação:
2 Abril 2021
Data De Atualização:
26 Junho 2024

Contente
- estágios
- Método 1 de 3: Nomenclatura de compostos iônicos
- Método 2 Nomenclatura de compostos poliatômicos
- Método 3 de 3: Nomenclatura de compostos covalentes
O sucesso no campo da química exige saber como nomear os compostos químicos básicos. Este guia fornece regras básicas sobre o processo de nomeação de compostos químicos e como atribuir nomes a compostos que você não conhece.
estágios
Método 1 de 3: Nomenclatura de compostos iônicos
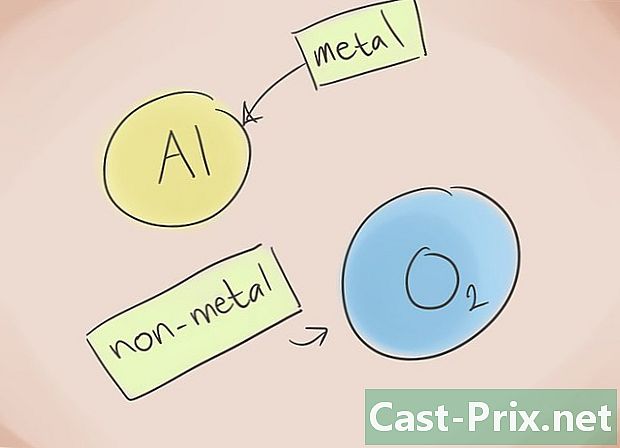
- O que é um composto iônico? Os compostos iônicos consistem em um metal e um não-metal. Em seguida, consulte a Tabela Periódica de Elementos para saber quais categorias pertencem aos elementos presentes no composto.
-

Forme o nome. Nada é mais fácil do que nomear um composto iônico de dois elementos. De fato, a primeira parte do nome do composto corresponde ao nome do elemento não metálico com o sufixo "ure", enquanto a segunda corresponde ao nome do elemento metálico. Existem exceções: óxido, fosfeto, nitreto, sulfeto.- Exemplo: Al2O3. ai2 = Alumínio; O3 = Oxigênio. Portanto, o nome do composto será "óxido de alumínio".
-
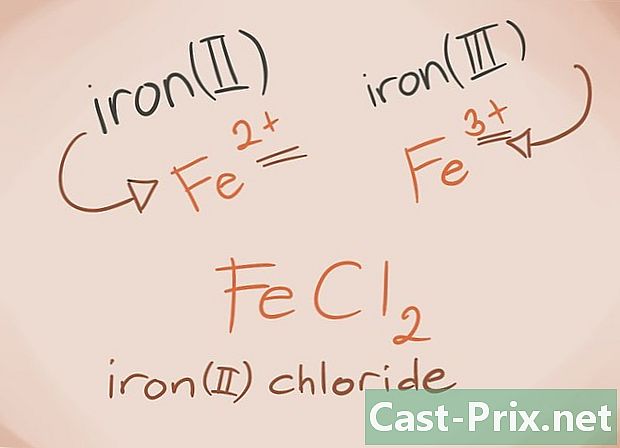
Conheça os metais de transição Os metais de transição são aqueles encontrados nos blocos D e F da tabela periódica. Em nome do composto, a carga sobre esses metais é escrita em algarismos romanos. Isso ocorre porque os metais de transição podem suportar mais carga e formar mais um composto.- Exemplo: FeCl2 e FeCl3. Fe = ferro; Cl2 = -2 Cloreto; Cl3 = Cloreto -3. Como nomes, haverá cloreto ferroso (II) e cloreto férrico (III).
Método 2 Nomenclatura de compostos poliatômicos
-

Você precisa entender o que é um composto poliatômico. Os compostos poliatômicos são compostos formados por um grupo de datomes associados entre si; todo o grupo que carrega uma carga é positivo ou negativo. Existem três ações básicas que você pode exercer sobre compostos poliatômicos:- Você pode adicionar um hidrogênio à primeira parte do composto. A palavra "hidrogênio" é realmente adicionada no início do nome do composto. Isso reduzirá o valor da carga negativa em um. Por exemplo, o CO "carbonato"3 torna-se o HCO "hidrogenocarbonato"3.

- Você também pode remover o oxigênio do composto. A carga não é alterada, mas o sufixo "-ate" do composto é alterado para "-ique". Por exemplo, a transformação de: NÃO3 em NÃO2 passamos de nitrato para nitrato. "

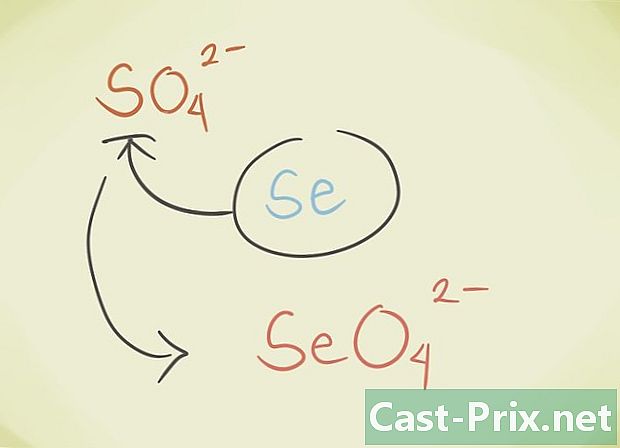
- Você pode substituir o latoma central do composto por outro átomo pertencente ao mesmo grupo periódico. Por exemplo, sulfato de SO4 pode ser substituído pelo Selenate SeO4.
- Você pode adicionar um hidrogênio à primeira parte do composto. A palavra "hidrogênio" é realmente adicionada no início do nome do composto. Isso reduzirá o valor da carga negativa em um. Por exemplo, o CO "carbonato"3 torna-se o HCO "hidrogenocarbonato"3.
-

Memorize os grupos dion mais comuns. Os grupos abaixo são usados para formar a maioria dos compostos poliatômicos. Seguindo a ordem crescente de sua carga negativa, temos:- íons hidróxido: OH
- iões nitrato: NÃO3
- Íons de carbonato de hidrogênio: HCO3
- íons permanganato: MnO4
- iões carbonato: CO3
- iões cromatos: CrO4
- iões dicromato: Cr2O7
- iões sulfato: SO4
- iões sulfitos: SO3
- iões tiossulfato: S2O3
- Iões fosfato: PO4
- iões de amónio: NH4
- Forme nomes compostos da lista acima. Forme uma associação de nome com qualquer um dos itens relacionados ao grupo. Se o elemento for colocado antes do grupo iônico, o nome do elemento será simplesmente adicionado ao início do nome do composto.
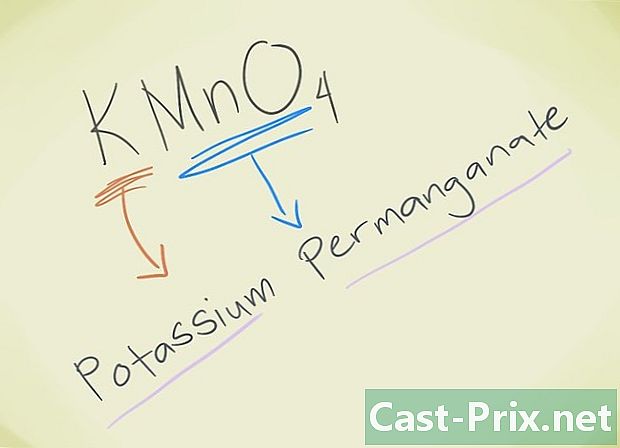
- Exemplo: KMnO4. Você deve saber que o leão MnO4 corresponde ao permanganato de leão. K refere-se ao potássio. Portanto, seu composto será chamado Permanganato de Potássio.
- Exemplo: NaOH. Você provavelmente já deve ter entendido aqui que é OHOH. Na é sódio, então o composto será chamado de hidróxido de sódio.

- Exemplo: KMnO4. Você deve saber que o leão MnO4 corresponde ao permanganato de leão. K refere-se ao potássio. Portanto, seu composto será chamado Permanganato de Potássio.
Método 3 de 3: Nomenclatura de compostos covalentes
-
O que é um composto covalente? Os compostos covalentes resultam da associação de pelo menos dois elementos não metálicos. O nome do composto é determinado pelo número de dados que o constituem. O prefixo grego ao lado desse nome indica o número de moléculas presentes no composto. -
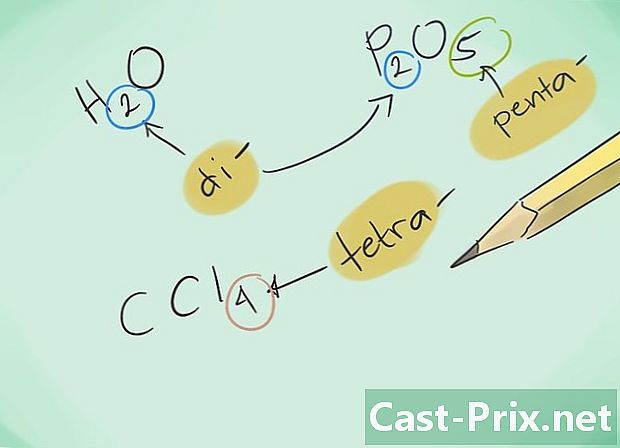
Familiarize-se com os prefixos. Memorize os seguintes prefixos para compostos de 1 a 8 átomos:- 1 átomo - "Mono-"
- 2 átomos - "Di-"
- 3 átomos - "Tri-"
- 4 átomos - "Tetra-"
- 5 átomos - "Penta-"
- 6 átomos - "hexa-"
- 7 átomos - "Hepta-"
- 8 átomos - "Oitava"
- Então nomeie os compostos. Nomeie o composto resultante usando os prefixos apropriados. Os prefixos devem ser enxertados em cada um dos elementos que constituem um composto com vários átomos.
- Exemplo: o CO retornará ao monóxido de carbono enquanto o CO2 designará dióxido de carbono.
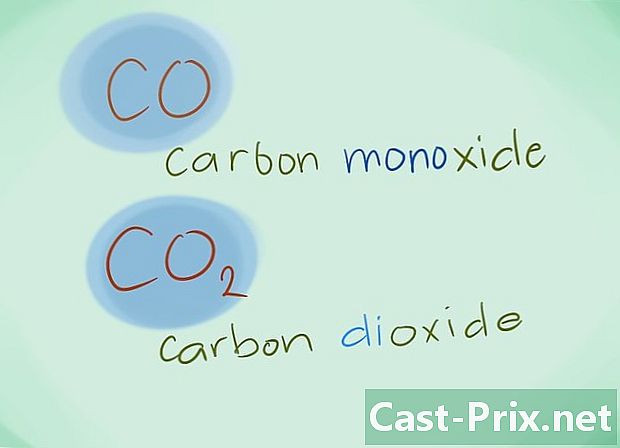
- Exemplo: N2S3 corresponderia a trissulfeto nitroso.

- Na maioria dos casos, o prefixo "mono" pode ser omitido; isso, mais do que qualquer falta de prefixo, induz que o último deve ser usado. Esse prefixo continua a ser usado no caso do monóxido de carbono, dado que esse uso remonta aos primeiros vislumbres da química.
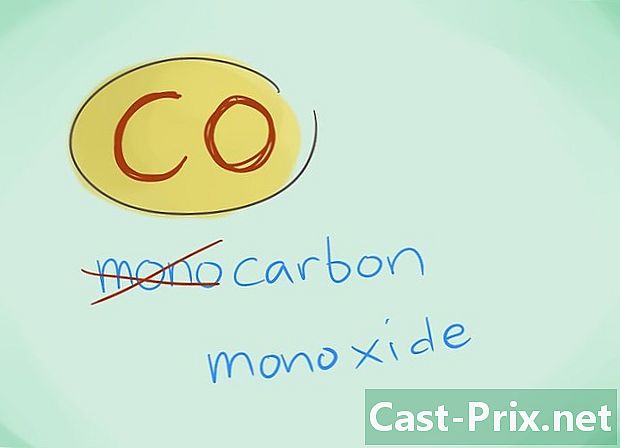
- Exemplo: o CO retornará ao monóxido de carbono enquanto o CO2 designará dióxido de carbono.
- Obviamente, você suspeita que várias exceções se apliquem a todas essas regras; por exemplo, esta fórmula, CaCl2Você espera vê-lo chamado "dicloreto de cálcio", que é NÃO. Seu composto simplesmente manterá o nome cloreto de cálcio.
- Note-se também que tudo isso não se aplica à química orgânica.
- As regras detalhadas aqui destinam-se a um público iniciante em química e ciência. Existem regras muito diferentes quando você passa pelo estágio avançado da química, como as regras sobre valência variável.

